1.1 Die laufende Neuproduktion von Ozon über den Tropen
In den oberen Schichten der Stratosphäre oberhalb 15 km Höhe bewirkt der besonders energiereiche Anteil des Sonnenlichts (UV-C) mit den noch kürzeren Wellenlängen als UV-B, nämlich unter 242 nm, die Spaltung von normalem Sauerstoff, der aus zwei Atomen besteht (O2) und molekularer Sauerstoff genannt wird. Die UV-C-Strahlung wird dadurch absorbiert und gelangt nicht mehr in tiefere Atmosphärenschichten, so daß sie weiter unten keinen Sauerstoff mehr spaltet. Dieser Vorgang findet vor allem über den Tropen statt, denn hier ist, bei hohem Sonnenstand, die UV-C-Strahlung am intensivsten. Die zwei einzelnen Sauerstoffatome (O) aus der Spaltung sind sehr reaktionsfreudig und verbinden sich mit einem ungespaltenen Sauerstoffmolekül (O2) zu Ozon, das aus drei Sauerstoff-Atomen besteht (O3). Das ist die Neubildung von Ozon aus der Sauerstoffspaltung, die relativ langsam, aber stetig geschieht.
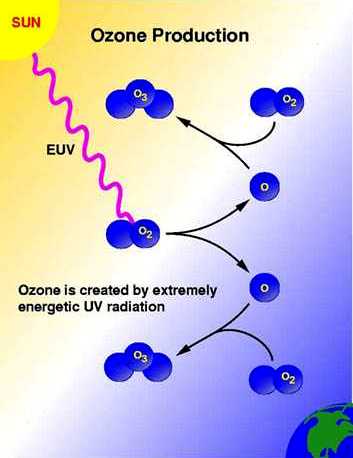 |
Abb. 2. Die Neubildung von Ozon aus Sauerstoff und UV-C-Strahlung (EUV = Energetic UV radiation). Quelle: NASA GSFC 1999. |
Da die Neubildung von Ozon hauptsächlich über den Tropen erfolgt, wo die Sonnenstrahlung am stärksten ist, liegt es nahe, dort die höchste stratosphärische Ozonkonzentration zu vermuten. In Wirklichkeit wird das meiste Ozon in den mittleren bis hohen Breiten der Nord- und Südhalbkugel gemessen. Über dem Äquator liegen die Werte bei 250 DU, in Mitteleuropa finden sich im Jahresmittel Gesamtozon-Werte von 340 bis 360 DU, über der kanadischen Arktis und Sibirien wurden Werte um 500 DU festgestellt. Der Grund dafür sind stratosphärische Winde (Brewer-Dobson-Zirkulation), die von den Tropen ozonreiche Luft wegtransportieren, und zwar sowohl zu den beiden Polen hin als auch abwärts in die tiefere Stratosphäre höherer geographischer Breiten. Die Ozon-Verfrachtung erfolgt je nach Klima und Luftzirkulation schubweise, was die gemessenen Schwankungen der Ozonkonzentration im Jahresverlauf erklärt.
| Die Neubildung von Ozon in chemischen Gleichungen | |||||
|---|---|---|---|---|---|
| 1. | O2 + UV-C | --> | O + O | ||
| 2. | O + O2 | --> | O3 | ||
| Neubildung von Ozon aus Sauerstoff: Durch UV-Strahlung der Wellenlänge < 242 nm wird Sauerstoff in seine beiden Atome gespalten (Gleichung 1). Die beiden Sauerstoffatome (O) verbinden sich mit molekularem Sauerstoff (O2) zu dreiatomigen Ozonmolekülen |
Die Ozonkonzentration ist noch von anderen natürlichen Faktoren abhängig, so u.a. von der etwa alle zwei Jahre wechselnden Windrichtung in der Stratosphäre über dem Äquator, von der mit dem Sonnenfleckenzyklus zu- und abnehmenden Strahlungskraft der Sonne (Solarstrom) und zeitweilig von großen Vulkanausbrüchen, die u.a. Schwefelsäureteilchen ausstoßen, die den Ozonabbau fördern.
1.2 Spaltung und Rückbildung des Ozons (Ozongleichgewicht)
Nach seiner primären Entstehung unterliegt das Ozon einem andauernden Wechsel von Spaltung und Rückbildung. Die Spaltung des Ozons erfolgt unter dem Einfluß von UV-B-Strahlung bei Wellenlängen unterhalb 320 nm. (Erst über 320 nm beginnt die Strahlung, die für den Menschen sichtbar und zugleich verträglich ist.) Das UV-B bricht die Bindung des Ozonmoleküls, das in molekularen (O2) und atomaren (O) Sauerstoff zerfällt. Die UV-Strahlung - wohlbemerkt: die zellschädigende UV-B-Strahlung der Wellenlänge 280-320 nm - verwandelt sich bei dieser Reaktion in Wärme, die an die Umgebung abgeht. Die Rückhaltung der UV-B-Strahlung von der Erdoberfläche erfolgt dadurch, daß sie vom Ozon absorbiert und in Wärme umgewandelt wird.
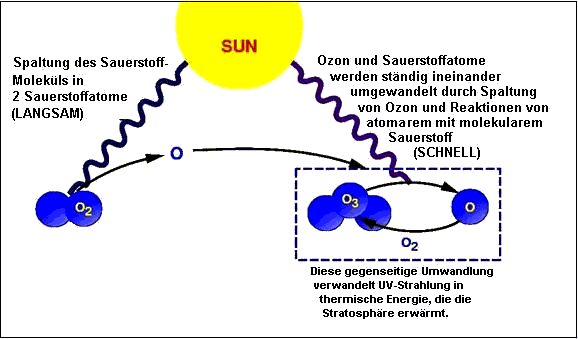
| Abb. 3. Neubildung von Ozon durch Sauerstoffspaltung und natürliches Ozongleichgewicht durch ständige Spaltung und Rückbildung. Quelle: NASA GSFC 1999, übersetzt. |
Die durchschnittliche Lebensdauer eines Ozonmoleküls bis zur erneuten Spaltung durch UV-B beträgt im Mittel weniger als eine Stunde. Der entstehende atomare Sauerstoff (O) hat sogar nur eine Lebensdauer von Sekundenbruchteilen. Er ist so reaktionsfreudig, daß er sich sofort mit dem nächsten Sauerstoffmolekül (O2) wieder zu Ozon verbindet. Spaltung und Rückbildung von Ozon stehen im Gleichgewicht. Die Wärmeabgabe bei der Ozonspaltung ist die Erklärung für den bereits erwähnten Umstand, daß die Temperatur der Stratosphäre mit der Höhe zunimmt.
| Ozonauf- und -abbau in chemischen Gleichungen | |||||
|---|---|---|---|---|---|
| 3. | O3 + UV-B | --> | O2 + O + W | ||
| 4. | O + O2 | --> | O3 | ||
| Stetige Spaltung und Rückbildung von Ozon. Ozon (O3) zerfällt unter UV-B-Strahlung in molekularen (O2) und atomaren Sauerstoff (O). Dabei wird Wärme (W) frei (Gleichung 3). In Sekundenbruchteilen verbindet sich atomarer Sauerstoff (O) wieder mit molekularem Sauerstoff (O2) zu Ozon (O3) |
1.3 Katalytischer Ozonabbau durch Spurenstoffe
Da Ozon im Kreislauf seiner Spaltung und Rückbildung nicht abnimmt und zugleich in der Stratosphäre der Tropen eine stetige Neuproduktion stattfindet, müßte die Ozonmenge in der Stratosphäre immer weiter zunehmen, wenn es keinen Endabbau gäbe. Diesen gibt es. Er wird durch sogenannte Spurenstoffe ausgelöst, die so heißen, weil sie nur in winzigen Konzentrationen bzw. Spuren in der Stratosphäre vorkommen: Chlor, Brom, Stickstoff, Wasserstoff. Genauer gesagt geht es um die vier Stoffpaare Cl/ClO, Br/BrO, NO/NO2, HO/HO2, die der Einfachheit halber auch als ClOx, BrOx, NOx, HOx abgekürzt werden. Diese Spurenstoffe kommen natürlicherweise in der Stratosphäre vor. Es gibt daher einen natürlichen Ozonabbauprozeß.
Die Spurenstoffe, ob Cl, Br, NO oder HO, bauen Ozon sehr wirksam ab, weil sie katalytisch reagieren. Katalytischer Abbau heißt, daß diese Stoffe mit dem O3 in der Weise reagieren, daß sie nach dessen Umwandlung in O2 wieder unverändert vorliegen und der Abbauprozeß von neuem beginnen kann. Dies wird hier exemplarisch am Chlor dargestellt. Die anderen Spurenstoffe verhalten sich analog.
| Katalytischer Ozonabbau durch Spurenstoffe in chemischen Gleichungen: hier ClOx | |||||
|---|---|---|---|---|---|
| 5. | Cl + O3 | --> | ClO + O2 | ||
| 6. | ClO + O | --> | Cl + O2 |
|
|
| Netto: | O3 + O | --> | 2 O2 | ||
| Gleichung 5: Ein Chloratom (Cl) reagiert mit Ozon (O3), es entstehen Chlormonoxid (ClO) und molekularer Sauerstoff (O2). Gleichung 6: Das Chlormonoxid reagiert mit atomarem Sauerstoff (O) aus einer anderen Ozonspaltung, bevor sich dieses O mit O2 wieder zu Ozon vereinigt. Es wird molekularer Sauerstoff (O2) gebildet, und das ursprüngliche Chloratom ist wieder frei. Ozon ist (siehe Nettogleichung) abgebaut. Das freie Chlor kann nun wieder O3 angreifen usw. usf. |
So kann etwa das Spurengas Chlor (Cl) rund 1000 O3-Moleküle nacheinander zerstören: Voraussetzung ist, daß das dabei jeweils entstehende ClO den Sauerstoff wieder abgibt. Denn nur als Cl, nicht als ClO kann Chlor Ozon angreifen. Stößt ClO statt auf ein Sauerstoffatom O auf einen anderen Spurenstoff, z.B. NO2 (der aus der Reaktion von NO mit O3 kommt), wird der Sauerstoff nicht frei, sondern ClO verbindet sich mit NO2. Es entsteht (Gleichung ClO + NO2 --> ClONO2) das reaktionsträge Chlornitrat (ClONO2), so daß der Ozonabbau zum Stillstand kommt. Denn im Chlornitrat sind sowohl ClO als auch NO2 "festgesetzt". Somit ist beim Ozonabbau ein Spurenstoff der Gegenspieler des anderen. Ihre Verbindung miteinander heißt "Reservoir-Gas".
Wird das Reservoirgas (hier Chlornitrat) nach einigen Tagen durch Sonnenstrahlung wieder gespalten, fängt die katalytische Kettenreaktion des daraus freigesetzten Chlors (ebenso wie des Stickoxids) erneut an. In seiner stratosphärischen Lebensdauer kann daher ein einzelnes Chloratom rund 100 000 Ozonmoleküle zerstören, bis es schließlich als Chlornitrat (viele andere Verbindungen wie z.B. HCl sind auch möglich) aus der Stratosphäre ausgeschleust, d.h. durch Luftbewegungen in die darunterliegende Troposphäre abgesenkt wird. Dort wird es in Wasserdampf gelöst und ausgeregnet oder ausgeschneit.
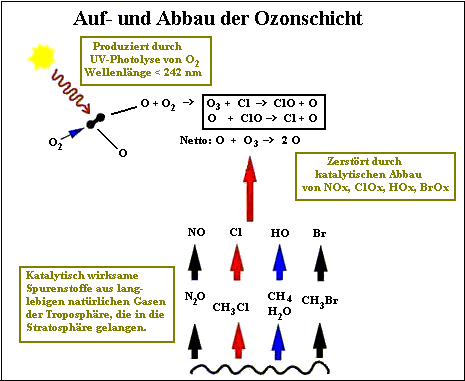
| Abb. 4. Ozongleichgewicht: Aufbau durch UV-C-Strahlung und katalytischer Abbau durch natürliche Spurenstoffe (hier in Schwarz der Chlorzyklus eingetragen). Quelle: NASA GSFC 1999, modifiziert. |
Die stratosphärischen Spurenstoffe Chlor (ClOx), Brom (BrOx), Stickoxide (NOx) und Wasserstoff (HOx), haben natürliche Quellen ("Quellgase") in der Troposphäre. Chlor und Brom stammen aus Methylchlorid und Methylbromid, Wasserstoff aus Methan und Wasserdampf, Stickoxide aus Lachgas. Alle sind langlebige Gase, die aus den Ozeanen oder vom Boden in die Stratosphäre aufsteigen. Erst dort zerlegt sie die energiereiche Sonnenstrahlung in die entsprechenden Spurenstoffe.
Diese Spurenstoffe spielen eine doppelte Rolle. Solange sie auf Ozon treffen, bauen sie es katalytisch ab. Treffen sie aufeinander, bilden sie inaktive Verbindungen (Reservoirgase), und der Ozonabbau steht still. Die Reservoirverbindungen werden entweder durch Strahlung wieder aufgelöst oder sie verlassen die Stratosphäre endgültig. Daß die Spurenstoffe erst 1000 Ozonmoleküle zerstören, bevor sie miteinander reagieren, liegt daran, daß die Konzentration von Ozon etwa 1000 Mal höher als ihre eigene ist. Der Zusammenstoß mit Ozon ist 1000 Mal wahrscheinlicher als mit einem anderen Spurenstoff.
Der Umfang des gesamten Ozons in der Stratosphäre wird durch das Verhältnis zwischen Neuproduktion und katalytischem Abbau reguliert. Käme von der Sonne mehr harte Strahlung unter 242 nm, würde mehr Ozon aus der Sauerstoffspaltung erzeugt, so daß die Ozonmenge anstiege. Würden dagegen mehr Chlor, Brom, Wasserstoff oder Stickoxide, also Spurenstoffe, eingetragen, würde die Ozonmenge durch katalytischen Abbau sinken, bis sich auf niedrigem Niveau ein neues Gleichgewicht eingestellt hätte. Strahlungsdichte und Spurenstoffkonzentration sind also die entscheidenden Faktoren.
Die vom Menschen verursachte (anthropogene) Ozonzerstörung beruht eben darauf, daß Chlor- und Brom-haltige Quellgase in nie dagewesenen Ausmaßen in die Stratosphäre gelangen. Zusätzliche anthropogene Freisetzung der anderen Quellgase Distickstoffoxid oder Wasserdampf spielt für den zusätzlichen Ozonabbau nur eine untergeordnete Rolle.

